Семейный эссенциальный тремор Минора
Семейный эссенциальный тремор Минора
 Сущность болезни. Семейный эссенциальный тремор Минора (СЭТМ) (наследственное дрожание, эссенциальный тремор) это тяжелое неврологическое расстройство в виде гиперкинезов (насильственных движений), которое иначе называют наследственным дрожанием или болезньюМинора (БМ). Болезнь описана Л. С. Минором в 1929 году. Автор подчёркивал отличительную особенность этого вида тремора - проявление при мышечном напряжении и движении. Заболевание встречается у людей среднего и пожилого возраста. По различным данным среди лиц моложе 40 лет эссенциальный тремор наблюдается у 0,3-6,7%, после 70 лет — у 8-17%. Болезнь носит наследственный характер и обусловлена мутацией генов. По статистике, эта патология встречается почти у 6% людей. Доказано, что наследованиеэссенциальноготремораимеет аутосомно-доминантный тип, то есть передается от родителя ребенку. Клинически БМ проявляется кинетическим и постуральным дрожанием рук, головы, нижней челюсти, губ, век, голосовых связок, реже — ног, туловища.
Сущность болезни. Семейный эссенциальный тремор Минора (СЭТМ) (наследственное дрожание, эссенциальный тремор) это тяжелое неврологическое расстройство в виде гиперкинезов (насильственных движений), которое иначе называют наследственным дрожанием или болезньюМинора (БМ). Болезнь описана Л. С. Минором в 1929 году. Автор подчёркивал отличительную особенность этого вида тремора - проявление при мышечном напряжении и движении. Заболевание встречается у людей среднего и пожилого возраста. По различным данным среди лиц моложе 40 лет эссенциальный тремор наблюдается у 0,3-6,7%, после 70 лет — у 8-17%. Болезнь носит наследственный характер и обусловлена мутацией генов. По статистике, эта патология встречается почти у 6% людей. Доказано, что наследованиеэссенциальноготремораимеет аутосомно-доминантный тип, то есть передается от родителя ребенку. Клинически БМ проявляется кинетическим и постуральным дрожанием рук, головы, нижней челюсти, губ, век, голосовых связок, реже — ног, туловища.Научное обоснование подхода: Наследственные болезни нервной системы (НБНС) – это заболевания, передающиеся из поколения в поколение или через поколение, обусловленные генными или хромосомными мутациями. При хромосомных мутациях в одних случаях различают нарушение числа хромосом (удвоение, утроение, отсутствие) или имеет место нарушение структуры хромосомы (делеции, инверсии, транслокации, дупликации). При генных мутациях изменения наблюдаются соответственно в генах на определенных участках хромосом. Генетические мутации при БМ должны верифицированы специалистами генетиками. Мутации могут включать или одну ДНК последовательность (простые мутации) или обмены между аллельными или неаллельными ДНК-последовательностями. Эти изменения являются причиной моногенных заболеваний – довольно разнородной по клиническим проявлениям группы болезней. Наличие выраженного фенотипического полиморфизма приводит к различным клиническим признакам у представителей даже одной семьи. Неврологическая симптоматика может быть представлена классическими развернутыми формами, разнообразными атипичными проявлениями и «стертыми» клиническими симптомами. При изучении распространенности и исходов тяжелых прогрессирующих НБНС нами было показано, что до определенного времени эти пациенты являются достаточно компенсированными и абсолютно здоровыми людьми и болезнь у них дебютирует в самые разные периоды их жизни (в детском или пубертатном периоде или в возрасте от 35 до 60 лет) в результате разных этиопатогенетических факторов. Человек узнает о болезни только тогда, когда она начинает прогрессировать и это главное требование к участию в данном протоколе. У больного должно быть прогрессирование наследственной болезни. В большинстве случаев, формируется лавинообразное нарастание дегенеративно-атрофических процессов в различных участках центральной нервной системы (ЦНС), приводящих к неврологическому дефекту. В ряде случаев, декомпенсация приводит к глубокой инвалидизации из-за аутоиммунных нарушений или даже к летальному исходу из-за возникновения онкологических осложнений. Эти витальные осложнения обусловлены в первую очередь формированием геномно-протеомных структурных нарушений (делеции, инверсии, транслокации, дупликации) в гемопоэтических стволовых клетках (ГСК) как следствие повреждений и разрывов ДНК в них. Таким образом, появление дополнительных мутаций генов приводит к глубокой инвалидности, деменции или летальному исходу в результате аутоиммунного воспаления, дегенерации нервной ткани или канцерогенного перерождения тканей пациента с НБНС.
Принцип терапии. Особая актуальность данной проблемы обусловлена отсутствием эффективных методов лечения прогрессирования и существующей возможностью повторных случаев возникновения болезни в последующих поколениях. Основные надежды при лечении СЭТМ возлагаются в будущем на технологии геномного редактирования. Но что делать сегодня если заболевание неуклонно прогрессирует? Можно ли его остановить? Да, можно и ответ на эти вопросы дали наши экспериментальные работы по реставрации смертельных мутаций поврежденных ГСК с использованием природоподобной технологии гомологичной рекомбинации (равнозначной замены) мутантных участков ГСК на двухцепочечную ДНК (дцДНК) здорового донора. Молекулярные исследования по реставрации смертельно поврежденных ГСК и МССК с большим количеством мутаций и повреждений ДНК, обусловленных 3-5 кратной фатальной дозой ионизирующего облучения позволило создать природоподобную революционную инновационную биотехнологию реставрации и замены мутантных участков ДНК на подобные участки здоровой донорской ДНК в процессе деления ГСК больного с СЭТМ.
Путем лейкоцитофереза собираются собственные мононуклеарные клетки и ГСК пациента с СЭТМ, инкубируют их с дцДНК здорового донора (разрешенная к клиническому применению в России лекарственная субстанция «ПАНАГЕН»). Часть этих реставрированных ГСК и МНК периферической крови применяется для реинфузии этих реставрированных клеток в кровь после иммуносупрессии, а другую часть используется для реставрации поврежденных нервных клеток мозга путем интратекальных введений этих клеток в спинно-мозговой канал.
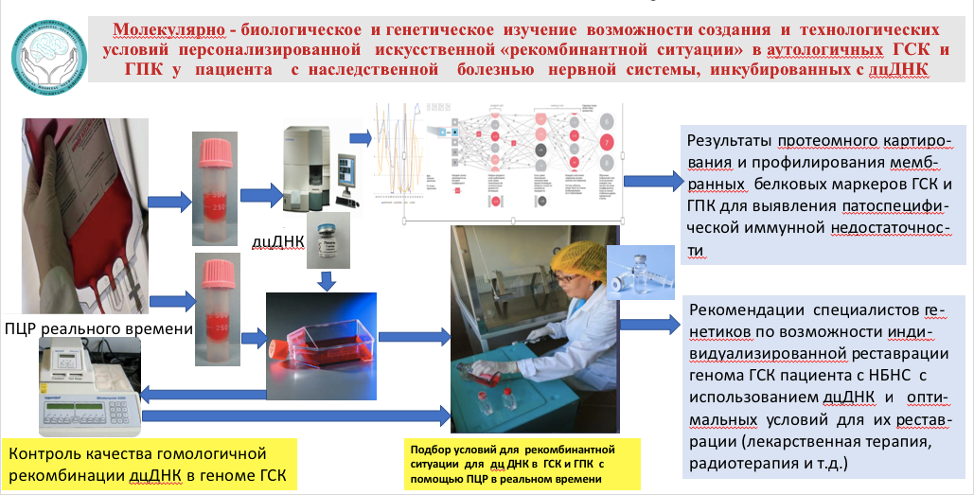
Результат. Технология не позволяет вылечить все генетические болезни человека, особенно такие сложные как СЭТМ, да и не ставит себе это в задачу, но она дает реальный шанс остановить прогрессирование наследственной нервной болезни за счет природоподобного молекулярного механизма гомологичной рекомбинации мутантных и поврежденных кусков ДНК ГСК и МНК на дцДНК здорового донора и в ряде случаев стабилизировать молекулярно-биологическую структуру неустойчивого генома нейронов, блокировать функционирование клонального гемопоэза у больного с СЭТМ, а также компенсировать неврологическое и соматическое состояние пациента.. Технология позволяет профилактировать возможность возникновения декомпенсации различных форм СЭТМ у здоровых компенсированных членов семьи с наследственной семейной отягощенностью и высоким риском развития болезни путем сбора собственных МНК и ГСК в состоянии компенсации и этим обеспечить биостраховку от возможного прогрессирования наследственной болезни путем реинфузии их при возникновении декомпенсации болезни.

 +7 (495) 147-49-49
+7 (495) 147-49-49 г. Москва, ул. Маршала Тимошенко, 7с1
г. Москва, ул. Маршала Тимошенко, 7с1 clinic@neurovita.ru
clinic@neurovita.ru.png)
 Молодежная
Молодежная .png)